글로벌 바이오시밀러 시장 규모, 점유율 및 추세, 코로나19 영향 분석 보고서, 제품별(재조합 인간 성장 호르몬(RHGH), 과립구 콜로니 자극 인자, 인터페론 등), 제조 유형별(자체 제조 및 계약) 제조), 기술별(재조합 DNA 및 단클론 항체), 용도별(외부 치료, 종양학, 만성 장애, 자가면역 질환 등) 및 지역별(북미, 유럽, 아시아 태평양, 라틴 아메리카, 중동, 및 아프리카), 분석 및 예측 2021~2030
산업: HealthcareSpherical Insights & Consulting의 최신 연구 보고서에 따르면 글로벌 바이오시밀러 시장 규모는 2021년에 176억 달러로 평가되었으며, 해당 시장은 2030년에 22.80%의 CAGR로 564억 달러 성장할 것으로 예상됩니다.
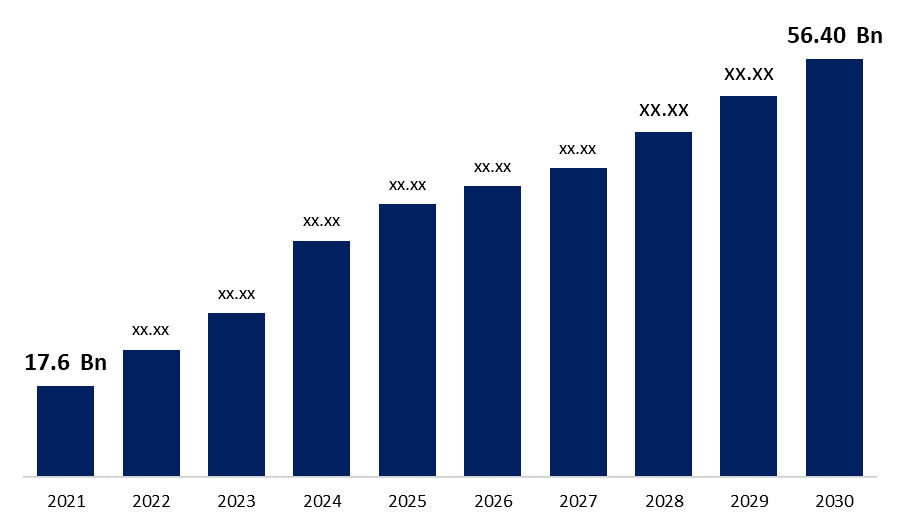
이 보고서에 대한 자세한 내용을 확인하세요 -
바이오시밀러는 이미 승인된 생물학적 약물(생물학적 참조 의약품)과 유사하지만 동일하지 않은 복제 의약품입니다. 많은 국가의 규칙에 따르면 "유사 생물학적 제제"는 유전 공학 기술을 사용하여 만들어지고 안전성, 효능 및 품질 측면에서 참조 생물학적 제제와 "유사"하다고 주장되는 생물학적 제품/의약품입니다. 바이오시밀러 의약품은 생물학적 참조 의약품과 유사한 활성 성분을 가지고 있으며 동일한 복용량으로 동일한 상태를 치료하는 데 사용됩니다. 엔티티 기반(제품 프로세스 포함), 규제 기반(신속한 테스트 중), 시장 기반은 모두 바이오시밀러(동일한 제조업체, 다른 상표명)를 설명하는 데 사용되는 용어입니다. 유사한 생물학적 제품, 후속 생물학적 제제, 후속 진입 생물학적 제제, 2차 진입 생물학적 제제, 생물 유전학, 다중 소스 제품 및 특허 만료 바이오 기술 제품은 모두 바이오시밀러의 동의어입니다. 일반 대중과 보험 회사는 비용 효율적인 옵션을 선호하지만 바이오시밀러를 사용하는 것의 장기적인 경제적 영향은 조사되지 않았습니다. 바이오시밀러 치료의 전체 비용이 증가할 수 있습니다.
보고서 " 글로벌 바이오시밀러 시장 규모, 점유율 및 추세, COVID-19 영향 분석 보고서, 제품별(재조합 인간 성장 호르몬(RHGH), 과립구 집락 자극 인자, 인터페론 및 기타), 제조 유형별(사내 제조 및 계약 제조), 기술별(재조합 DNA 및 단일 클론 항체), 응용 분야별(사외 치료, 종양학, 만성 질환, 자가 면역 질환 및 기타) 및 지역별(북미, 유럽, 아시아 태평양, 라틴 아메리카, 중동 및 아프리카), 분석 및 예측 2021-2030 "
글로벌 바이오시밀러 시장 보고 범위
| 보고 범위 | Details |
|---|---|
| 기준 연도: | 2021 |
| 시장 규모 2021: | 176억 달러 |
| 예측기간: | 2021-2030 |
| 예측 기간 CAGR 2021-2030 : | 22.80 % |
| 2030 가치 예측: | 564억 달러 |
| 에 대한 과거 데이터: | 2017-2020 |
| 페이지 수: | 214 |
| 표, 차트 및 그림: | 110 |
| 해당 세그먼트: | 제품별, 제조 유형별, 기술별, 애플리케이션별, 지역별 |
| 해당 기업:: | Sandoz, Pfizer, Biocon Limited, Fresenius Kabi AG, Boehringer Ingelheim, Mylan N.V, Organon Group of Companies, Eli Lilly and Company, Teva Pharmaceutical Industries Ltd, Dr. Reddys Laboratories, Amgen Inc, Celltrion, Leo Pharma, MSD, Sanofi, Novartis, Mundipharma, AbbVie, Others |
| 함정과 과제: | 코로나19 영향, 도전, 미래, 성장 및 분석 |
이 보고서에 대한 자세한 내용을 확인하세요 -
바이오시밀러는 특허 만료된 생물학적 제제와 같은 방식으로 안전하고 효과적이도록 설계된 새로운 종류의 약물입니다. 생물학적 제제의 활성 단백질 구조는 급성적이고 지속적인 면역 반응을 유발할 가능성이 더 높습니다. 바이오시밀러는 전반적인 위험이 낮지만 구조적 복잡성, 제조 방법 및 면역원성 위험으로 인해 규제 절차가 필요합니다.
바이오시밀러의 문제점/제한에는 두 바이오시밀러가 서로 다른 기원을 가지고 있고, 동일한 치료 효능을 가질 수 있으며, 다른 부작용을 가질 수 있어 광범위한 테스트가 필요하다는 점이 있습니다. 많은 생물학적 약물에 대한 특허 보호 만료는 바이오시밀러 약물 개발의 주요 동인입니다. 활성 물질의 크기와 복잡성, 제조 공정의 특성으로 인해 바이오제약은 기존의 저분자 약물과 다릅니다. 공정의 사소한 변화조차도 치명적인 결과(공정이 제품임), 안전성 및 효능 문제로 이어질 수 있습니다.
FDA의 목적은 "인간 및 수의학 의약품, 생물학적 제품 및 의료 기기의 안전성, 효능 및 보안을 보장하여 대중의 건강을 보호하는 것"입니다. FDA는 바이오시밀러 개발을 신중하게 규제하며, 각 신청은 참조 생물학적 제제와 별개이지만 동등하게 까다로운 요구 사항에 따라 기관에서 종합적인 평가를 받습니다. 결과적으로 환자와 처방자는 참조 생물학적 제제와 동일한 품질, 안전성 및 효능을 기대할 수 있습니다. 참조 생물학적 제제의 개발 및 규제 평가는 일반적으로 3상 임상 데이터에 초점을 맞추는 반면, 바이오시밀러의 개발 및 평가는 대부분 차이점을 감지하는 데 가장 민감한 참조 생물학적 제제와의 비교에 초점을 맞춥니다.
바이오시밀러 개발은 규제, 제조, 마케팅 측면에서 복잡성이 높아 제약 산업에서 가장 비용이 많이 드는 개발 노력 중 하나입니다. 바이오시밀러는 제네릭 의약품과 마찬가지로 의료비를 낮추는 것을 목표로 시장에 출시됩니다. 그러나 바이오시밀러 진입에는 임상 개발 측면에서 더 높은 비용, 더 큰 위험, 더 많은 시간과 전문성이 필요합니다. 더욱이 바이오시밀러는 소분자 제네릭과는 다른 마케팅 및 출시 접근 방식이 필요합니다. FDA 승인을 받고 제조 능력을 개발하는 데 드는 상당한 비용으로 인해 바이오시밀러 경쟁자의 수가 제한될 것입니다.
이러한 상황에서는 몇몇 바이오시밀러 제조업체만이 특정 혁신 약물에 대한 시장에 진입하려 할 가능성이 높으며, 혁신 제품 가격의 10%~30% 할인된 가격으로 약물을 제공할 가능성은 낮습니다. 더욱이 바이오시밀러와 오리지널 제품 간에 자동 대체가 없기 때문에 바이오시밀러가 시장 점유율을 확보하는 속도가 더 느릴 것입니다. 결과적으로 바이오시밀러 연구에 필요한 리소스의 유형과 수가 소규모에서 중규모 기업뿐만 아니라 더 크고 잘 정립된 제네릭 회사와 다국적 바이오제약 회사에도 진입에 상당한 장애물이 될 수 있는 방식을 이해하기 쉽습니다. 85–87 혁신자보다 더 나은 이점이 없고 비용 절감이 미미할 경우 바이오시밀러의 시장 점유율을 확보하는 것이 어려울 수 있습니다. 수많은 바이오시밀러가 시장에 출시되면 가격을 낮출 수 있습니다.
바이오시밀러가 혁신 의약품과 유사함에도 불구하고, 의사와 의료 종사자는 이러한 약물의 개발 및 승인 과정에서 제기된 몇 가지 우려 사항을 알고 있어야 하며, 이는 바이오시밀러의 한계를 강조합니다. 바이오시밀러의 사용은 임상 실무의 변화를 수반합니다. Pan American and Health Education Foundation은 바이오시밀러의 위험과 이점에 대해 환자와 의료 전문가를 교육하는 데 중요한 역할을 함으로써 환자 안전을 강화하는 데 적극적으로 관심을 가지고 있습니다.
바이오시밀러 제품의 안전성, 효능 및 품질을 보장하기 위해 FDA는 상호 교환 가능한 바이오시밀러를 포함한 바이오시밀러를 승인할 수 있는 권한을 부여받았습니다. FDA는 2009년 바이오로직스 가격 경쟁 및 혁신법에 따라 이미 승인된 약물과 "바이오시밀러"인 생물학적 제제의 승인을 위한 "축소된 경로"를 모니터링할 권한이 있습니다. 단축된 방법은 동물과 인간 모두에서 불필요하고 비윤리적인 바이오시밀러 테스트를 최소화합니다. 이를 통해 시간, 비용 및 인적 자원을 절약할 수 있습니다. 이는 2010년 환자 보호 및 저렴한 의료법(미국)에서도 지원됩니다. 바이오시밀러의 도입은 신중하게 고안된 약물 안전 감시 전략을 필요로 합니다.
바이오시밀러는 현재 미국, 일본, 유럽의 제약 시장에서 주요 부분을 차지하고 있는데, 이는 생물학적 약물보다 저렴하기 때문입니다. 예를 들어, 바이오시밀러는 유럽에서 21개가 승인된 기존 생물학적 약물보다 30% 저렴합니다. 반면에 의사의 18%만이 이러한 동일한 생물학적 제약적 차이를 알고 있습니다. 2022년과 2030년 사이에 66개의 생물학적 미국 특허가 만료되기 때문에 FDA는 2021년에 더 많은 바이오시밀러 신청을 평가할 것으로 예상하고 있으며, 바이오시밀러 사업은 새로운 시장을 개척하면서 큰 진전을 앞두고 있습니다. 더욱이 이러한 제약품이 직면한 특허 절벽은 연간 수십억 달러 규모의 약물 판매로 이어질 것입니다. 미국과 일본은 생물학적 약물에 가장 많은 비용을 지출하기 때문에 가장 크고 가장 중요한 바이오시밀러 시장 중심지가 될 것으로 예상됩니다. 2021년까지 특허만료 의약품이 시장의 절반 이상을 차지할 것으로 추산되며, 이는 바이오시밀러에 엄청난 성장 기회를 제공할 것입니다.
이 보고서에 대한 자세한 내용을 확인하세요 -
최초의 바이오시밀러는 2015년 미국에서 승인되었고, 2020년에 12개의 생물학적 특허가 만료됨에 따라 바이오시밀러는 경쟁적인 방식으로 생물학적 사업을 인수할 가능성이 높습니다. 나아가 바이오시밀러는 2021년까지 생물학적 시장의 4%~10%를 차지할 것으로 예상됩니다. 지금까지 가장 성공적인 미국 바이오시밀러(Zarxio)는 미국 필그라스팀 시장의 55% 이상을 차지했습니다(Hagen, 2020). 반면에 바이오시밀러는 미국에서 수용이 느렸습니다. 가장 큰 미국 상업 건강 보험의 바이오시밀러 적용 결정에 대한 새로운 검토에 따르면, 해당 결정의 14%만이 바이오시밀러에 우선 적용을 부여했습니다(Chambers et al., 2020). 유럽은 일반적으로 상당히 높은 바이오시밀러 흡수율, 어떤 경우에는 최대 100%로 평가되지만, 이 부문에서의 지배력은 종종 과장되어 있습니다. 일부 유럽 국가는 특정 치료 분야에서 큰 바이오시밀러 시장 점유율을 가지고 있지만, 바이오시밀러 채택은 유럽 전역과 제품 종류에 따라 크게 다릅니다(IQVIA, 2019b).
2018년에 16개 유럽 국가가 90%가 넘는 필그라스팀과 페그필그라스팀 바이오시밀러를 사용했지만, 아일랜드에서는 필그라스팀과 페그필그라스팀 바이오시밀러의 27%만 사용되었습니다(IQVIA, 2019b). 노르웨이와 덴마크는 항종양괴사인자 바이오시밀러(아달리무맙, 에타네르셉트, 인플릭시맙)를 가장 많이 채택했으며, 각각 81%와 96%를 차지했고, 다른 모든 국가는 50% 미만을 차지했습니다(IQVIA, 2019b).
분할
제품별로
- 재조합 인간 성장 호르몬 (RHGH)
- 과립구 집락 자극 인자
- 인터페론
- 다른 사람들
생산 유형별
- 자체 제조
- 제조사와 계약
기술로
- 재조합 DNA
- 단일클론 항체
응용 프로그램별로
- 오프사이트 처리
- 종양학
- 만성질환
- 자가면역질환
- 다른 사람들
지역별로
- 북미 – 미국, 멕시코, 캐나다
- 유럽 - 영국, 프랑스, 독일, 이탈리아, 스페인 및 기타 유럽
- 아시아 태평양 – 중국, 일본, 인도, 한국 및 기타 아시아 태평양
- 남미 - 브라질, 아르헨티나, 콜롬비아, 기타 남미
- 중동 및 아프리카 - GCC, 남아프리카, 기타 중동 및 아프리카
이 보고서를 구매하는 데 도움이 필요하십니까?